科研进展
屠红/甘愉团队解析热量限制抑制肿瘤生长的免疫新机制
日期:2025-12-23
2025年12月5日,上海交通大学医学院附属仁济医院-上海市肿瘤研究所屠红/甘愉团队,联合仁济医院临床研究中心李佩盈团队,在Cell Metabolism发表了题为 “Restricting Lipid Accumulation in Tumor-Infiltrating Neutrophils Mediates Caloric Restriction Induced Anti Cancer Effects”的研究论文。该研究揭示以肿瘤浸润中性粒细胞脂质代谢为核心的热量限制(Caloric Restriction, CR)抗肿瘤新机制,为靶向中性粒细胞开发新型肿瘤治疗策略提供了重要理论依据。
CR作为一种经典的饮食干预模式,其核心是在避免营养不良的前提下,适度减少饮食中的热量摄入。动物实验和人类流行病学研究显示,CR不仅能有效降低肿瘤发生率,还可以抑制肿瘤进展、增强治疗效果。然而,CR 对饮食控制要求较高,肿瘤患者往往难以长期坚持,从而限制了其临床转化与应用。因此,从细胞和分子水平深入解析 CR 抗肿瘤的作用机制,是开发安全可行的肿瘤干预策略的关键突破口。
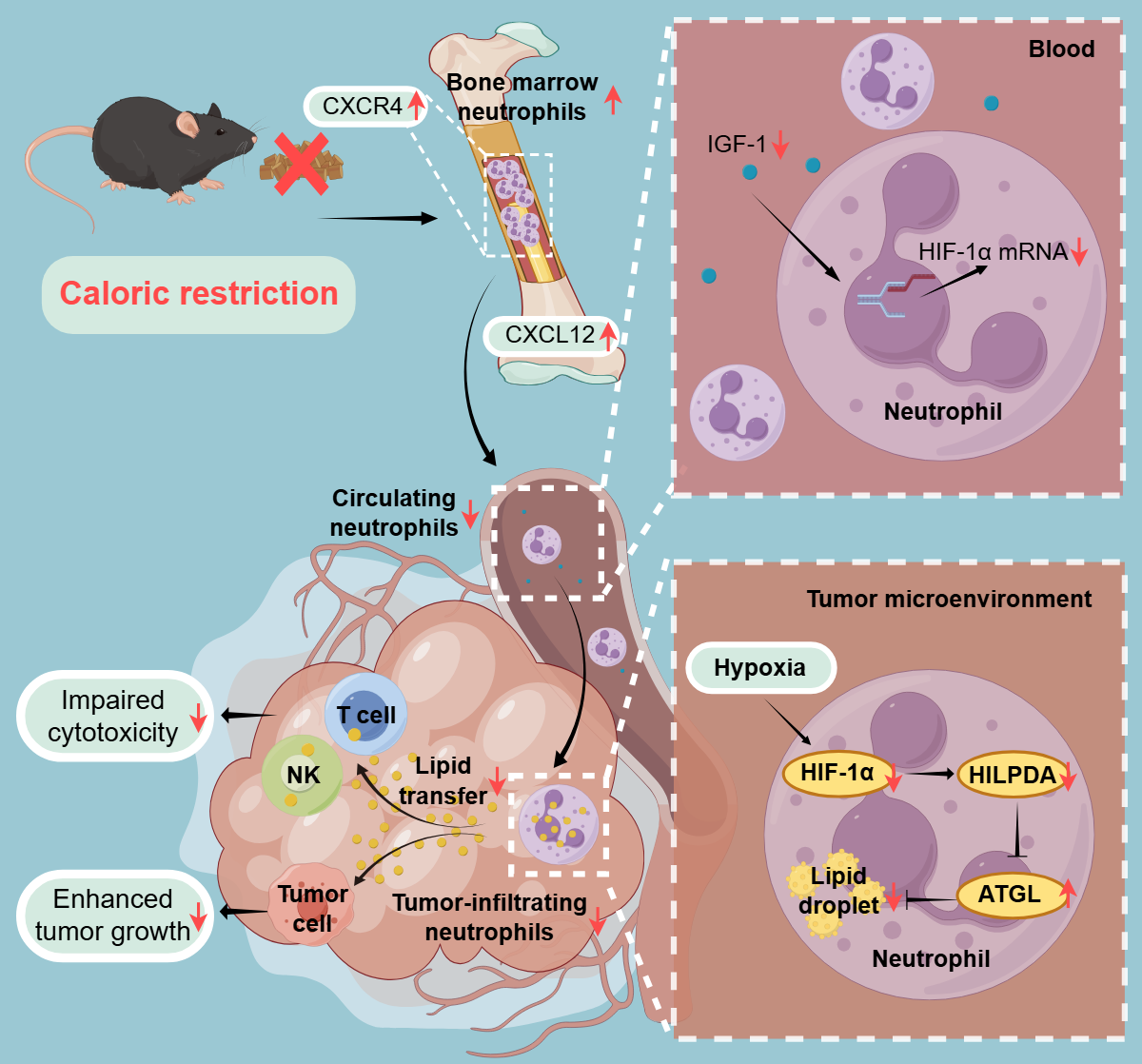
研究团队采用阶梯式热量限制的方案构建CR小鼠模型(摄入量维持在正常水平的75%),证实其对胰腺癌、肝癌、肺癌等多种常见恶性肿瘤具有显著抑瘤效应。通过单细胞测序将研究重点聚焦于中性粒细胞,并发现清除该细胞后CR抗肿瘤作用大幅削弱,提示中性粒细胞是CR发挥作用的关键枢纽。机制探索发现,CR对中性粒细胞的调控体现在两个层面:一是限制中性粒细胞从骨髓释放入血,从而显著减少了肿瘤内中性粒细胞的浸润数量;二是重塑中性粒细胞基因表达谱,其中脂质代谢相关通路的改变最为突出,尤以脂质分解抑制因子HILPDA(hypoxia-inducible droplet-associated)的下调最为显著。功能研究表明,CR或中性粒细胞条件性敲除HILPDA均能减少细胞内的脂质堆积,并产生双重抗肿瘤效应:一方面减少向肿瘤细胞供应脂质,从而抑制其增殖;另一方面降低向CD8+ T和NK细胞的脂质输送,解除其免疫抑制状态,进而增强肿瘤微环境中的免疫应答。特异性敲除中性粒细胞中的HILPDA后,CR抑制中性粒细胞脂质堆积现象消失,其抗肿瘤效应也随之削弱,证实了HILPDA是CR调控中性粒细胞功能的关键分子靶点。在胰腺癌、肝癌、肺癌、结直肠癌等多种恶性肿瘤患者中,肿瘤浸润中性粒细胞中HILPDA的高表达与的不良预后显著相关,凸显了这一发现的临床转化价值。进一步追溯HILPDA上游调控通路发现,CR能通过降低外周血IGF-1,下调循环中性粒细胞中HIF-1α的基础转录水平,这使得中性粒细胞即便进入缺氧的肿瘤微环境,也会因HIF-1α蛋白水平有限而导致下游靶基因HILPDA的转录受到抑制。
综上,本研究首次揭示了中性粒细胞是CR抑制肿瘤的关键调控细胞,并解析出CR通过IGF-1/HIF-1α/HILPDA信号轴调控中性粒细胞脂质代谢,从而抑制肿瘤的完整通路,不仅为靶向中性粒细胞开发肿瘤治疗策略提供了潜在靶点,也为我国传统养生箴言“饭吃七分饱”提供了现代科学实验的注解。
需要提醒的是,该研究是在体重正常的小鼠中,采用了先CR后接瘤的实验顺序,结果提示了饮食控制在增强机体抗肿瘤免疫中的潜在价值。但并无证据表明,该饮食干预措施可直接推广至已发生体重下降、甚至出现恶液质的中晚期肿瘤患者。
上海交通大学医学院附属仁济医院/上海市肿瘤研究所助理研究员高见博士和硕士研究生张威为本文的共同第一作者,甘愉研究员、屠红研究员和仁济医院临床研究中心李佩盈主任医师为共同通讯作者。该工作得到了西湖大学张兵研究员的合作支持,并受到国家自然科学基金委、上海市科学技术委员会、肿瘤系统医学全国重点实验室相关课题的资助。
原文链接:https://www.cell.com/cell-metabolism/abstract/S1550-4131(25)00491-7
