科研进展
覃文新/王存团队揭示CD49f阳性肝癌细胞亚群免疫逃逸机制和精准治疗策略
日期:2024-11-112024年11月7日,上海交通大学医学院附属仁济医院-上海市肿瘤研究所覃文新/王存团队在Cancer Cell上发表了题为Targeting the immune privilege of tumor-initiating cells to enhance cancer immunotherapy的研究。该研究结合类器官与单细胞多组学技术,全面分析了十余种肿瘤起始细胞标志物分子,发现CD49f高表达肝癌细胞通过CXCL2-CXCR2轴招募中性粒细胞,形成独特的免疫抑制微环境。中性粒细胞通过分泌CCL4进一步维持肿瘤起始细胞特性,并赋予这些细胞“免疫特权”,即通过表达CD155逃避CD8+ T细胞介导的免疫攻击。研究还指出,联合靶向PD-1和CD155的治疗策略不仅能清除CD49f高表达肝癌起始细胞,还能破坏其依赖的免疫抑制微环境,从而显著提高免疫治疗疗效。

肿瘤起始细胞是一群具有自我更新能力并能够驱动肿瘤发生、维持和复发的细胞亚群。它们在肿瘤异质性、侵袭性和耐药性方面发挥关键作用。在肝癌中,通常使用细胞表面蛋白,如CD24、CD44、CD90、CD133和EPCAM等,来识别潜在的肿瘤起始细胞。然而,如此多的潜在候选分子带来一个问题,即如何鉴别和确定这些标志物分子在肝癌精准诊疗中的作用和重要性。CITE-seq技术能够在单细胞层面同时分析转录组和细胞表面蛋白的表达,为研究者提供了研究多种表面标志物分子生物学特性及其相互作用的机会。本研究中,研究者对来自LICOB生物库的肝癌类器官进行了CITE-seq测序,对14个经典肿瘤起始细胞标志物分子和5个免疫抑制相关的表面标志物分子进行了全面分析研究。结果提示,不同标志物分子在样本间的表达具有显著的异质性,并且它们标示肿瘤起始细胞的能力也存在显著差异。在这些标志物分子中,CD49f展现了最低的表达异质性和功能异质性,显示出高效的肿瘤起始细胞标示能力。CD49f由ITGA6基因编码,是一种细胞表面整合素蛋白,已被证明与细胞干性相关,但在肝癌起始细胞研究中,其应用潜力未被揭示。
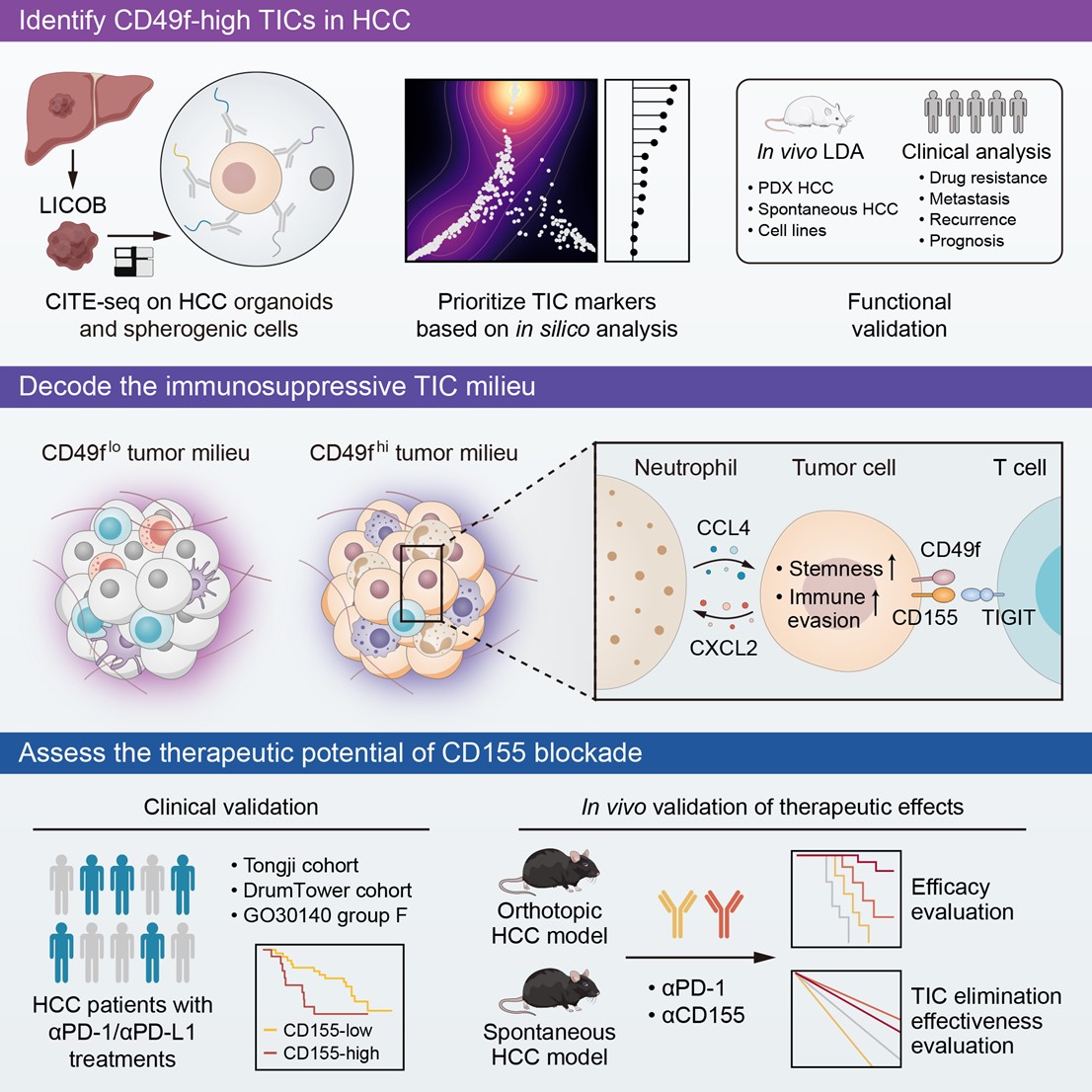
在探究CD49f高表达肿瘤细胞的生物学功能时,研究者发现这些细胞分泌大量招募髓系细胞的相关因子。进一步分析显示,CD49f高表达肝癌细胞与中性粒细胞之间存在密切的相互作用,通过SOX9驱动的CXCL2分泌招募中性粒细胞,而中性粒细胞则通过CCL4-STAT3轴维持并促进肿瘤起始细胞特性。CCL4-STAT3轴的激活还会增强PVR(即CD155编码基因)的表达。此外,CD49f在细胞膜上与CD155发生相互作用,进一步在蛋白水平稳定CD155。在这两种机制共同作用下,CD49f高表达的肝癌细胞通过高表达CD155获得“免疫特权”,从而逃避CD8+ T细胞介导的免疫攻击。有趣的是,这种“免疫特权”也成为这类细胞的“免疫弱点”。研究者提出联合靶向PD-1和CD155的治疗策略,不仅能够清除这些肿瘤起始细胞,还能减少肿瘤微环境中免疫抑制性中性粒细胞的浸润。
上海市肿瘤研究所王存研究员、复旦大学附属中山医院高强教授、上海市肿瘤研究所覃文新研究员、上海交通大学医学院郑铨博士、德国癌症研究中心孙崇教授为本文通讯作者。本文的第一作者为杨晨博士、耿海刚博士、杨旭鹏博士、纪姝伊副研究员、刘志承博士和冯浩博士。荷兰癌症研究所René Bernards院士、上海交通大学医学院金光植研究员、海军军医大学第三附属医院(东方肝胆外科医院)袁声贤主任医师和华中科技大学同济医学院附属同济医院冷超教授为本研究提供了重要支持。本项目得到国家自然科学基金委和上海市科学技术委员会相关计划资助。
原文链接:https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00396-9
