科研进展
薛婧团队揭示表观遗传失调调控胰腺肿瘤癌相关成纤维细胞异质性及代谢重塑
日期:2024-05-30新闻提要
近日,我所兼聘研究员、肿瘤系统医学全国重点实验室研究员、上海仁济医院干细胞中心的薛婧团队在Cancer Cell杂志上在线发表题为:Tumor cell-intrinsic epigenetic dysregulation shapes CAF heterogeneity to metabolically support pancreatic cancer的文章,首次报道了肿瘤固有表观失调影响癌相关成纤维细胞异质性的理论和机制。该研究在组蛋白甲基转移酶SETD2缺陷型胰腺肿瘤中鉴定出一类富脂型CAF亚群,揭示了表观遗传元件调控肿瘤细胞-CAF交互作用的分子机制,并为SETD2缺陷型胰腺癌患者精准诊疗提供了新策略。

胰腺癌是恶性程度最高的消化道肿瘤之一,其发生发展受肿瘤细胞内在和肿瘤微环境的共同调控。肿瘤相关成纤维细胞(CAF)是胰腺癌微环境中最丰富的基质细胞类型,与肿瘤发展、治疗抵抗等密切相关。近些年随着单细胞转录组测序(scRNA-seq)等新兴技术的发展,揭示了CAF在功能和转录层面的异质性。目前胰腺肿瘤中主要包含三个亚群,即肌成纤维细胞CAF (myofibroblast,myCAF),炎性CAF( inflammatory fibroblast,iCAF) 以及抗原递呈CAF(antigen-presenting CAFs, apCAF)。不同的CAF亚群具备不同的功能,因而其异质性会直接影响肿瘤的特性。CAF的异质性受到肿瘤细胞及微环境中多重因素的调控,其中细胞因子作为经典的细胞间通讯媒介,在CAF分化过程中起重要作用,如IL-1促iCAF分化、TGFβ促myCAF分化(Cancer Discovery, 2019)。最新研究显示肿瘤细胞中遗传突变和信号通路是CAF异质性的驱动因素(Cancer Discovery,2023;Cancer Cell, 2024)。胰腺肿瘤中存在大量的表观遗传元件突变/失调,那么肿瘤内固有表观失调是否会影响CAF异质性?此前尚未见报道。
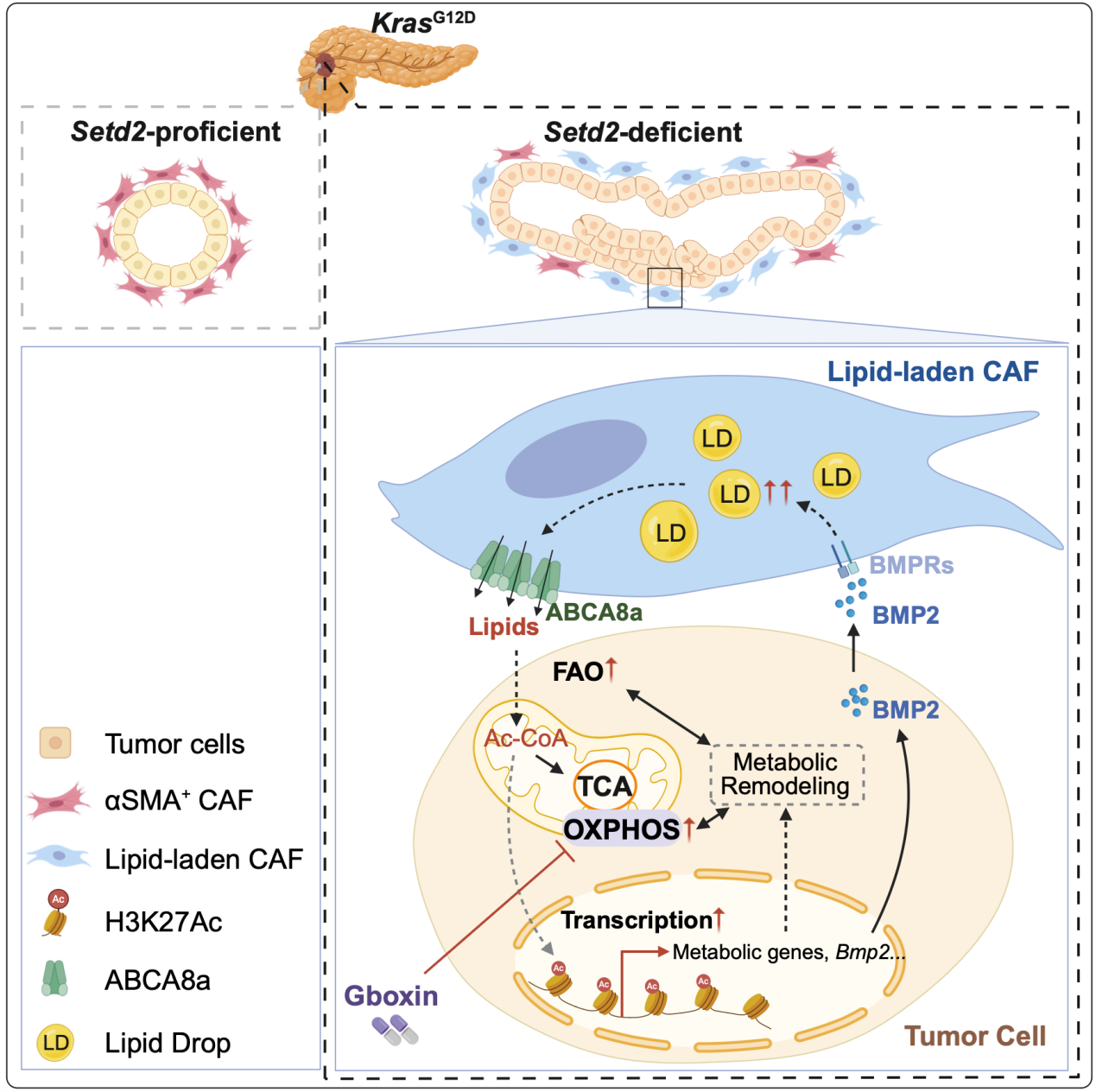
该研究通过胰腺癌临床公共数据库、小鼠胰腺肿瘤单细胞测序以及代谢功能实验,明确了KRAS突变联合SETD2缺陷型胰腺肿瘤细胞具有以氧化磷酸化(OXPHOS)为主的代谢特征 (而KRAS联合P53突变的胰腺肿瘤是以糖酵解代谢为主)。筛选三大主要代谢物来源发现脂肪酸β氧化升高是OXPHOS增强的主因。有趣的是,SETD2缺陷型胰腺肿瘤中鉴定出一群富脂型CAF。通过转录组特征进行分析,发现该群CAF细胞呈现与以往报道CAF亚群迥异的特征: 1)成脂通路(adipogenesis)富集,中性脂类含量丰富;2)具ABCA8a特异性标记;3)空间分布上紧靠肿瘤细胞,CellChat分析显示肿瘤细胞-CAF之间存在强BMP2-BMPR信号通讯。
进一步机制探索了这类富脂型CAF的调控和功能机制。SETD2缺陷型胰腺肿瘤细胞通过BMP2-BMPR信号轴激活CAF细胞成脂途径,促进其脂质合成。 反过来,这类富脂型CAF通过ABCA8a 转运蛋白反向给肿瘤细胞供给脂质, 促进SETD2缺陷型肿瘤细胞内脂肪酸氧化-OXPHOS代谢重塑以及干性增强。通过转录组-CUT&Tag联合分析显示,SETD2缺陷型肿瘤细胞内通路的改变并非受H3K36me3丢失的直接调控,而主要由SETD2缺陷引发的H3K27Ac重排贡献。
SETD2在胰腺癌患者中存在3-8%突变,和约三分之一比例低表达。目前为止,尚无针对SETD2或H3K36me3的特异性小分子药物。SETD2缺陷型胰腺癌OXPHOS增强的代谢特征有望被靶向。S-Gboxin是近年报道的小分子,能够特异性作用于过强的OXPHOS(如代谢旺盛的肿瘤细胞)而对健康体细胞影响较小。我们首先证实S-Gboxin显著性抑制SETD2缺陷小鼠胰腺肿瘤。进一步在多个胰腺癌临床cohort中证明H3K36me3与ABCA8a+ CAF显著负相关,并利用PDX临床前模型初步探索发现S-Gboxin对H3K36me3低表达的胰腺肿瘤具有更显著的抑制效果。
综上所述,该研究首次报道了胰腺肿瘤中表观元件失调通过重塑CAF异质性而促进其代谢重塑的作用机制。丰富了胰腺肿瘤微环境CAF调控理论,也为特殊突变肿瘤类型的精准治疗提供了靶向策略。过去几年,薛婧团队围绕组蛋白甲基转移酶SETD2,在胰腺癌中开展了系统性工作。从肿瘤细胞命运、免疫微环境、CAF异质性和代谢重塑等多重角度解析了SETD2缺失促进胰腺肿瘤发生发展的作用机制,研究成果先后发表于Gut(2020)、Advanced Science(2023)、Cancer Cell (2024)。以上工作提示获得一种突变的克隆能够在肿瘤进化过程中被正向选择,其必有获得恶性表型的能力、逃避机体免疫监管以及抵抗代谢等压力的潜力。通过对表观元件突变/失调多重作用的探索,可臻知肿瘤的特性,进而提出多元靶向策略。
该研究论文的通讯作者为上海交通大学医学院附属仁济医院、我所肿瘤系统医学全国重点实验室的薛婧研究员。仁济医院副研究员牛宁宁、博士研究生沈叙清、以及西安交通大学第一附属医院胰腺外科王铮主任为论文的共同第一作者。本研究得到了上海交通大学医学院附属仁济医院胆胰外科和肿瘤科,西安交通大学第一附属医院胰腺外科,上海交通大学医学院附属瑞金医院胰腺外科,以及南京医科大学第一附属医院胰腺中心的大力支持。
原文链接:https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00090-4
