科研进展
我所覃文新/金浩杰团队利用CRISPR-Cas9进行全基因组筛选找到肝癌新弱点
日期:2022-12-21
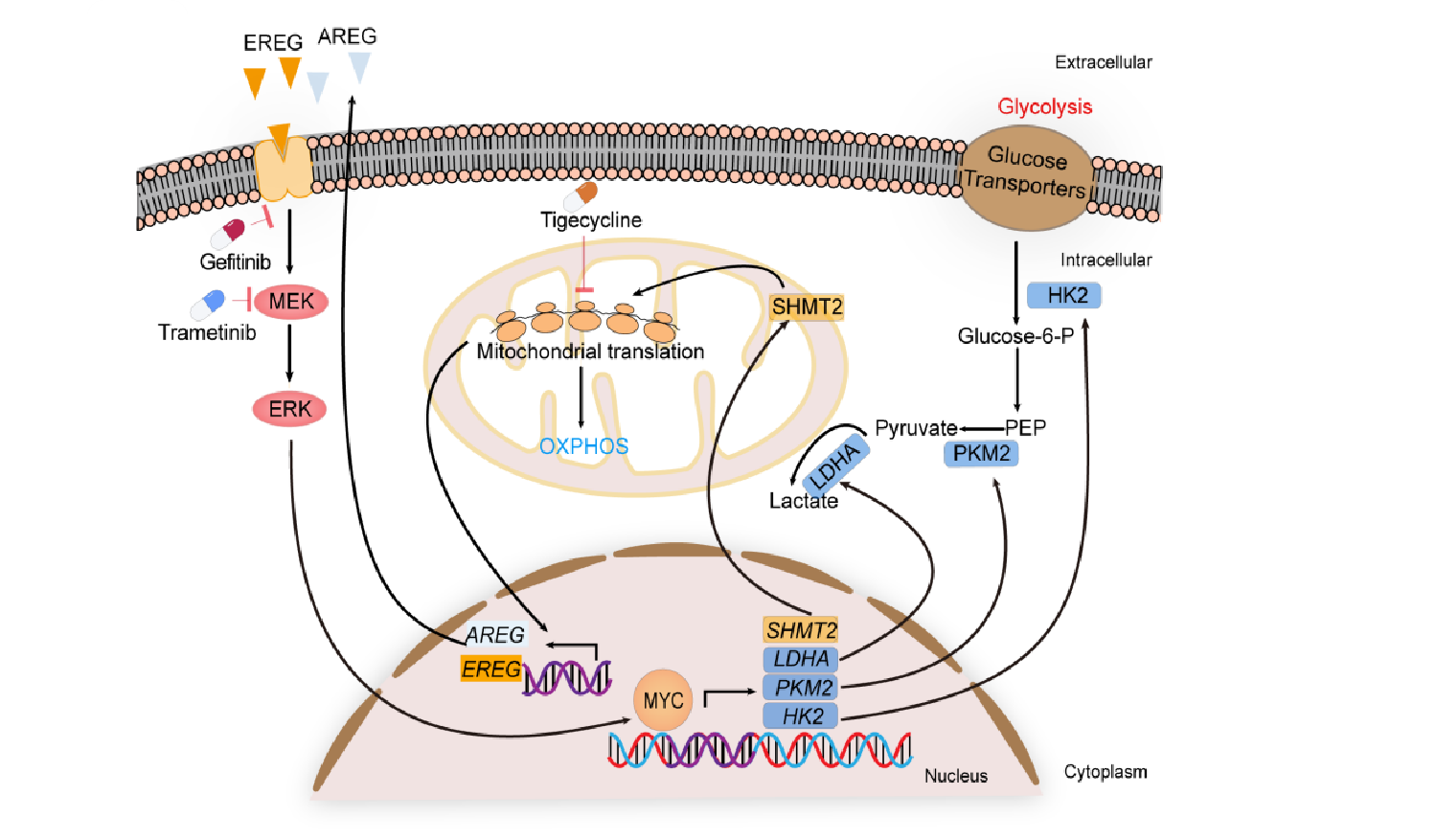
近日,柳叶刀旗下刊物eBioMedicine在线发表了上海交通大学医学院附属仁济医院/上海市肿瘤研究所覃文新研究员和金浩杰研究员团队题为Sustained activation of EGFR-ERK1/2 signaling limits the response to tigecycline-induced mitochondrial respiratory deficiency in liver cancer的研究论文[1]。该研究通过使用全基因组CRISPR-Cas9高通量功能基因筛选技术,发现靶向干预肿瘤细胞线粒体翻译过程具有重要的肝癌治疗潜力。而EGFR-ERK1/2信号通路的持续激活可导致肝癌细胞对线粒体翻译抑制剂替加环素不敏感。因此,MEK抑制剂或EGFR抑制剂与替加环素联用可发挥协同效果,有望为肝癌患者提供一种新的联合治疗方案。
肝癌是一种多基因参与、多因素介导、病理机制复杂的恶性肿瘤。在过去十年中,随着第二代基因组测序技术迅速发展,人们对肝癌的遗传特征有了较全面的了解。大规模肝癌样本测序结果表明,肝癌发生发展过程中存在大量基因突变,如 TERT 启动子、Wnt/β-catenin 信号通路基因(CTNNB1 和 AXIN 1)和细胞周期调节相关因子(TP53、CDKN2A 和 RB1)等[2, 3]。然而,与黑色素瘤中BRAF突变或肺癌中EGFR突变等不同,肝癌的这些突变尚无法进行有效靶向[4]。目前已经上市的肝癌靶向治疗方法有限。因此,运用新技术新方法探索肝癌生物学特性、寻找新的分子靶点和有效治疗策略,是当前肝癌研究的重点和难点。
成簇规律性间隔短回文重复序列(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)技术自2012 年诞生以来,在基因编辑方面展现出强大的应用潜能。2014 年,由此衍生来的CRISPR-Cas9功能基因筛选技术,已逐步成为探索基因功能、解析生物学过程与疾病发生发展机制以及发现疾病治疗靶点的重要手段。在该研究中,研究人员首先通过CRISPR-Cas9方法对2种常见肝癌细胞系的19114个基因进行筛选,分析出哪些是对肿瘤细胞生长与存活重要的基因,结果鉴定出455个共有的癌症基因靶标。进一步对上述筛选获得的基因靶标进行聚类分析发现,其中26个基因都与肝癌细胞的线粒体翻译过程相关,提示线粒体翻译过程可能是肝癌的适应性弱点,靶向干预该过程具有肝癌治疗潜力。
真核生物的线粒体中存在独立的翻译体系,人体的线粒体核糖体负责合成13个组成氧化磷酸化复合物的基本蛋白亚基。在正常细胞中,异常翻译蛋白聚集物对线粒体功能是有害的,会破坏细胞中化学能的稳态。然而,肿瘤细胞和正常细胞中的线粒体功能存在很大的差异。越来越多的证据表明,高水平的线粒体翻译过程可参与支持多种类型肿瘤细胞的生物能量需求[5]。替加环素是FDA唯一批准的甘环素类抗生素,已被证明可特异地抑制线粒体翻译过程[6]。为了验证CRISPR-Cas9筛选结果,研究人员通过检测11株肝癌细胞对替加环素的敏感性,发现其中8株肝癌细胞对替加环素敏感,仅有3株肝癌细胞对替加环素极不敏感。为了进一步解决少部分肝癌细胞对替加环素不敏感的问题,研究人员通过使用包含了1957个FDA批准药物的化合物库进行筛选,发现MEK抑制剂明显提高替加环素对肝癌细胞的体外抑制作用。
为了进一步阐明肝癌细胞耐受替加环素作用的分子机制,研究人员对替加环素处理的肝癌细胞进行了转录组测序、受体酪氨酸激酶阵列分析及酶联免疫吸附测定,发现替加环素不敏感肝癌细胞在替加环素作用下,EGFR的两种配体AREG和EREG自分泌增多并激活EGFR-ERK1/2信号通路,进而导致MYC下游糖酵解相关酶己糖激酶2(HK2)、丙酮酸激酶2(PKM2)和乳酸脱氢酶(LDHA)表达及活性增强。此外,研究人员还发现EGFR-ERK1/2-MYC信号轴可通过激活丝氨酸羟甲基转移酶2(SHMT2)部分维持线粒体翻译功能。
因此,替加环素与MEK抑制剂或EGFR抑制剂联合方案减少了代偿性糖酵解水平的增加,可彻底阻断肝癌细胞中糖酵解与氧化磷酸化之间的能量平衡过程。最后,研究人员在多种动物肿瘤模型中验证了替加环素联合MEK抑制剂或EGFR抑制剂的肝癌协同治疗效果。
上海交通大学医学院附属仁济医院/上海市肿瘤研究所博士生周洋洋、助理研究员王思颖和博士生吴维为论文共同第一作者。上海交通大学医学院附属仁济医院/上海市肿瘤研究所覃文新研究员、金浩杰研究员、荷兰癌症研究所René Bernards教授以及东方肝胆外科医院袁声贤副主任为论文共同通讯作者。
参考文献:
1. Zhou Y, Wang S, Wu W, Ling J, Li H, Jia Q, Zheng J, Zheng X, Yu R, Wu Q, Shi Y, Lieftink C, Beijersbergen RL, Yuan S, Bernards R, Jin H, Qin W. Sustained activation of EGFR-ERK1/2 signaling limits the response to tigecycline-induced mitochondrial respiratory deficiency in liver cancer. EBioMedicine. 2022 Dec 8;87:104397. doi: 10.1016/j.ebiom.2022.104397. Online ahead of print
2. Llovet JM, Montal R, Sia D, Finn RS. Molecular therapies and precision medicine for hepatocellular carcinoma. Nat Rev Clin Oncol. 2018 Oct;15(10):599-616.
3. Zucman-Rossi J, Villanueva A, Nault JC, Llovet JM. Genetic Landscape and Biomarkers of Hepatocellular Carcinoma. Gastroenterology. 2015 Oct;149(5):1226-1239.
4. Ferguson FM, Gray NS. Kinase inhibitors: the road ahead. Nat Rev Drug Discov. 2018 May;17(5):353-377.
5. Škrtić M, Sriskanthadevan S, Jhas B, et al. Inhibition of Mitochondrial Translation as a Therapeutic Strategy for Human Acute Myeloid Leukemia. Cancer Cell. 2011;20(5):674–88.
6. Kuntz EM, Baquero P, Michie AM, et al. Targeting mitochondrial oxidative phosphorylation eradicates therapy-resistant chronic myeloid leukemia stem cells. Nat Med. 2017;23(10):1234–40.
