科研进展
覃文新团队发表长篇述评:阐述CRISPR-Cas9高通量功能基因筛选技术在肝癌研究中的应用及发展趋势
日期:2021-06-246月23日,上海交通大学医学院附属仁济医院上海市肿瘤研究所覃文新团队在Nature Reviews Gastroenterology & Hepatology发表题为Exploring Liver Cancer Biology through Functional Genetic Screens的长篇述评[1]。述评全面总结了CRISPR-Cas9功能基因筛选技术在肝癌中的研究进展,阐述了当前利用该技术在探索肝癌发生发展和耐药机制以及开发治疗新靶点新策略等方面的进展,同时对肝癌研究的瓶颈问题与未来发展趋势提出了见解和思考。

肝癌是一种多基因参与、多因素介导、病理机制复杂的恶性肿瘤。全球每年新增原发性肝癌84万多例,死亡78万多例[2],其中约半数发生在我国,是我国高发癌种[3]。肝细胞癌(Hepatocellular carcinoma,HCC)是原发性肝癌的主要类型,约占肝癌患者的85%-90%[4]。对于早期肝癌,手术切除是有效治疗手段,由于肝癌早期诊断困难,病情进展快,大部分患者确诊时已进展到中晚期,失去了手术机会,5年生存率仅15-18%左右。
近年来,随着高通量测序技术的快速发展及广泛应用,已鉴定驱动肝癌发生发展的关键基因突变如TERT启动子、TP53、CTNNB1、ARID1A、AXIN1等[5]。然而与黑色素瘤中的BRAF突变或肺癌中的EGFR突变等不同,肝癌中的大多数突变无法直接作为有效药物靶点。作为目前临床上肝癌治疗的一线药物多激酶靶点抑制剂Sorafenib和Lenvatinib,仅能提供有限的生存获益[6]。近年来,免疫检查点阻断(Immune checkpoint blockade,ICB)疗法在肿瘤治疗领域受到广泛关注,但临床患者的总体反应率仅为10-20%[7]。最新IMbrave150试验显示,Atezolizumab(PD-L1抑制剂)和Bevacizumab(血管生成抑制剂)联合使用显著改善了进展期肝癌患者预后,但反应率也仅为27.3%[8]。近期,复旦大学附属中山医院樊嘉团队的一项随机、开放标签 2-3 期多中心临床研究显示,信迪利单抗(sintilimab,PD-1 抑制剂)加 IBI305 (贝伐单抗生物仿制药)与索拉非尼相比,显示出显著的总生存期和无进展生存期获益,且安全性可接受,为不可手术切除的肝癌患者提供了一种治疗选择[9]。
尽管过去十余年对肝癌治疗的探索已取得了一些突破,但仍面对肝癌研究领域中最亟待解决的关键问题:进展期肝癌缺乏有效治疗手段且目前标准疗法治疗效果有待进一步提高[10]。本述评中,作者系统介绍了不同高通量功能基因筛选平台的原理和优缺点,并从如何鉴定肝癌发生发展的驱动基因、探索肝癌药物反应敏感性和耐药机制以及如何开发肝癌治疗新靶点这三个方面系统阐述了利用高通量功能基因筛选平台取得的诸多突破和进展。不仅如此,在如何将成果转化为临床治疗方案问题上,作者进一步分析了可能面临的挑战与潜在的机遇。在肝癌异质性、复发和转移以及肿瘤免疫等研究领域,作者指出CRISPR-Cas9高通量功能基因筛选技术平台具有较大的应用价值和发挥空间,而这些研究最终将有助于加深我们对肝癌的理解,开辟新的潜在治疗策略。
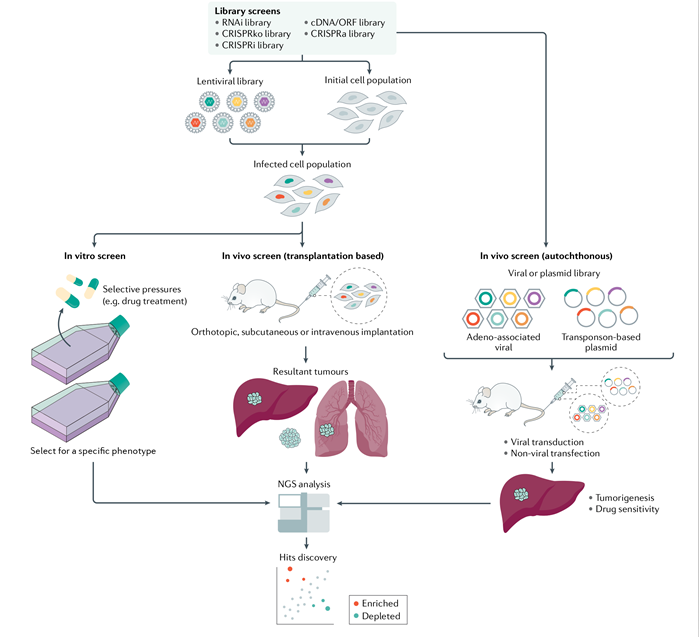
CRISPR-Cas9高通量功能基因筛选技术平台
CRISPR-Cas9功能基因筛选技术以高通量方式筛选和鉴定肿瘤发生发展相关基因,促进了癌症研究的进步[11]。这种高通量筛选平台为探索耐药机制和发现治疗靶点等提供了有效工具,述评对覃文新团队运用CRISPR-Cas9功能基因筛选技术在进展期肝癌治疗方面的探索进行了概要阐述[1, 12-15]。
上海市肿瘤研究所覃文新研究员、王存研究员,荷兰癌症研究所René Bernards院士为述评共同通讯作者,上海市肿瘤研究所王存研究员、曹颖博士和硕士研究生杨晨为本文共同第一作者。
[1] Wang C, et al. Exploring Liver Cancer Biology through Functional Genetic Screens. Nat Rev Gastroenterol Hepatol. 2021 June 23, Online ahead of print.
[2] Bray F, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2018, 68:394-424.
[3] Allemani C, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018, 391(10125):1023-1075.
[4] Villanueva A. Hepatocellular Carcinoma. N Engl J Med. 2019, 380:1450-1462.
[5] Zucman-Rossi J, et al. Genetic Landscape and Biomarkers of Hepatocellular Carcinoma. Gastroenterology. 2015, 149(5):1226-1239.
[6] Kudo M, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018, 391(10126):1163-1173.
[7] Finn RS, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. J. Clin. Oncol. 2020, 38:193-202.
[8] Finn RS, et al. IMbrave150 Investigators. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020, 382(20):1894-1905.
[9] Ren Z, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2–3 study. Lancet Oncol. 2021 Jun 15, Online ahead of print.
[10] Llovet JM, et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 2016, 2:16018.
[11] Shalem O, et al. High-throughput functional genomics using CRISPR-Cas9. Nat Rev Genet. 2015,16:299-311.
[12] Wang C, et al. Inducing and exploiting vulnerabilities for the treatment of liver cancer. Nature. 2019, 574(7777):268-272.
[13] Wang C, et al. CDK12 inhibition mediates DNA damage and is synergistic with sorafenib treatment in hepatocellular carcinoma. Gut. 2020, 69(4):727-736.
[14] Wang C, et al. A CRISPR screen identifies CDK7 as a therapeutic target in hepatocellular carcinoma. Cell Res. 2018, 28(6):690-692.
[15] Wang C, et al. Phospho-ERK is a biomarker of response to a synthetic lethal drug combination of sorafenib and MEK inhibition in liver cancer. J Hepatol. 2018, 69(5):1057-1065.
本文链接:https://www.nature.com/articles/s41575-021-00465-x
